Begleitdiagnostik des Endometriums in der assistierten Reproduktion
Durch die Forschungsarbeiten am humanen Endometrium, beginnend am Institut für Anatomie und Reproduktionsbiologie 1993, unter Führung von Professor Dr. med. Dr. rer. nat. Henning M. Beier, hat PD Dr. Joachim Alfer intensiv Untersuchungen am humanen Endometrium durchgeführt, deren Ergebnisse sich in den angefügten Publikationen wiederspiegeln.
Weiterhin haben langjährige Zusammenarbeiten mit IVF-Zentren im In- und Ausland die Erkenntnisse zur Beurteilung des Endometriums in diesem Bereich erweitert und ihn zu einem wichtigen Partner der kooperierenden Reproduktionsmediziner gemacht.
Weiterhin besteht eine Kooperation mit der Frauenklinik an der Universität Erlangen, Leitung Professor Dr. Matthias W. Beckmann, speziell mit dem IVF- und Endokrinologischen Labor unter der Leitung von Professor Dr. Ralf Dittrich.
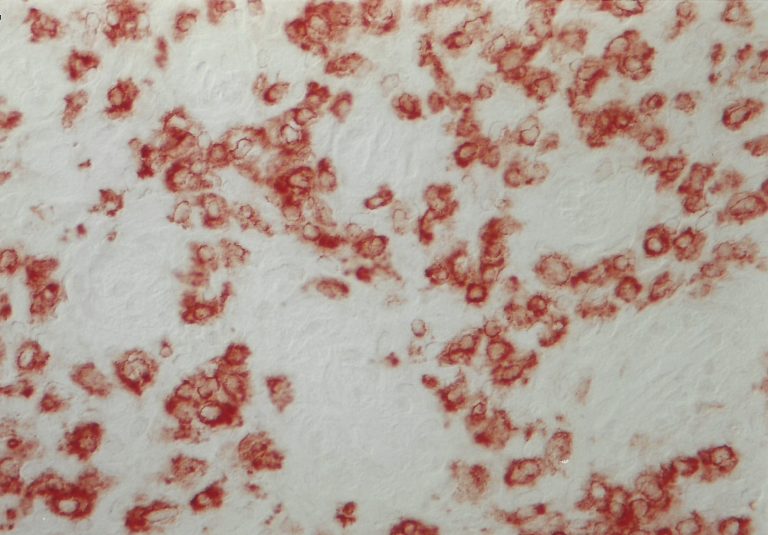
Immunhistochemie: CD56 positive uterine NK-Zellen am Zyklustag 25 (Kryostatschnitt, humanes Endometrium).
Für die Entstehung einer Schwangerschaft ist die Interaktion verschiedener Organe bzw. Organsysteme der sog. ´Reproduktiven Achse´ notwendig. Eine Fehlfunktion kann zur Infertilität führen. Man spricht dabei, entsprechend dem Organ, das kausal die Infertilität bedingt, von einem ovariellen, tubaren, cervikalen oder endometrialen Faktor. Das Endometrium, dessen einzige Funktion die Reproduktion ist, steuert die Einnistung des Embryos, weshalb ihr eine besondere Bedeutung im Bereich der in-vitro-Fertilisation (IVF) zukommt. Störungen der komplexen Prozesse der Implantation (Embryo-Maternaler-Crosstalk) können Ursache der weiblichen Infertilität sein. Die Untersuchung endometrialer Gewebeproben im nativen oder stimulierten Zyklus (Kryozyklus), kann relevante Erkenntnisse generieren, die möglicherweise zu einer Änderung der Vorgehensweise in der Therapie führen.
Eigene Analysen haben gezeigt, dass das Endometrium einer Gruppe von infertilen Patientinnen nicht in ein für die Implantation rezeptives Endometrium transformiert. Offensichtlich liegt ein Maturationsdefekt des Gewebes vor, dessen Ursachen noch nicht geklärt sind. In der Folge kann dies zu einem Implantationsversagen und somit zur Infertilität führen. Es handelt sich in diesen Fällen um den sog. „endometrialen Faktor“, der zur Infertilität führt.
In Zusammenarbeit mit IVF-Zentren zeigte sich jedoch, dass die endometriale Entwicklung innerhalb eines Zyklus, hinsichtlich der Rezeptivität des Endometriums, häufig eine Abweichung vom erwarteten Zyklustag, mit einer individuellen dynamischen Maturation des Endometriums in der Sekretionsphase, aufweist. Die Gewebeproben werden mittels Pipelle® gewonnen.
Aus den vorgenannten Gründen scheint das Endometrium bei der IVF nicht selten eine Art „Black Box“ zu sein, da in der Regel keine Analyse des Gewebes in Bezug auf die Maturation und Rezeptivität im Transferzyklus, oder vorangegangenen Zyklus, durchgeführt wird und somit wichtige Informationen für den adäquaten Zeitpunkt des Embryotransfers nicht vorliegen. Präliminäre Untersuchungen in Zusammenarbeit mit IVF-Kliniken haben bereits ergeben, dass in einzelnen Fällen die histologische Untersuchung bei der Findung des optimalen Transferzeitpunkts einen wesentlichen Beitrag leisten kann.
Bislang wurden endometriale Gewebeproben in der Routineuntersuchung nicht weiter untersucht. Jetzt besteht die Möglichkeit, aus diesen und weiteren zu gewinnenden Proben, zusätzliche Informationen über die Ursache der Infertilität der Patientinnen und über das Implantationsfenster zu erhalten.
Die endometrialen Gewebeproben können aufgrund der heterogenen Problematik der IVF-Patientinnen in Gruppen mit unterschiedlichen Fragestellungen eingeteilt werden.
A)
Analyse der endometrialen Gewebeproben von Patientinnen in der klinischen Routine der IVF (z.B. Hysteroskopie).
Vergleich der endometrialen Entwicklung im nativen Zyklus (z.B. im diagnostischen Zyklus ohne Stimulation) sowohl histomorphologisch als auch auf Rezeptorebene. Erkenntnisse können eventuell zu einer veränderten Vorgehensweise bei der Auswahl des Transferzeitpunktes oder des Transferzyklus ergeben.
B)
Monitoring von nativen und stimulierten Zyklen infertiler Patientinnen mit verzögerter Ovulation bzw. verzögerter Transformation des Endometriums.
Hierbei werden endometriale Biopsien (mittels Pipelle)
a, am Tag 5 (P +5)
b, und Tag 10 (P +10)
nach Ovulation / Progestroneinahme genommen.
Die 2. Entnahme (b) soll dazu dienen, vor Allem diejenigen Patientinnen identifizieren zu können, die eine verzögerte Endometriumsentwicklung aufzeigen. (Am Entnahmetag sollte Progesteron bestimmt werden.)
C)
Untersuchung von Patientinnen mit klinisch fehlendem Aufbau des Endometriums im nativen Zyklus, bei regelrechter Ovulation und adäquatem Hormonlevel.
Monitoring des Zyklus mit Entnahme von Gewebeproben kurz vor der Ovulation sowie am Tag 5 und 10 nach Ovulation wäre optimal.
Personalisierte Endometriale Maturations Analyse (PEMA®)
Es handelt sich bei dieser Untersuchung um ein Monitoring des humanen Endometriums innerhalb eines nativen, oder auch artifiziellen Menstruationszyklus.
Es werden endometriale Gewebeproben mittels Pipelle am Tag Ovulation +5 (P +5 = 6. Tag der Progesteroneinnahme) und Ovulation +10 (P +10 = 11. Tag der Progesteroneinnahme) entnommen. Nach Möglichkeit sollten jeweils zwei Gewebeproben von 0,5 cm bis 1 cm Länge gewonnen werden.
Klinische Angaben über den bisherigen Verlauf der Therapie, den derzeitigen Aufbau des Endometriums (z. B. trilaminar Pattern, Höhe des Endometriums in mm, Besonderheiten z. B. Septum) natürlicher oder artifizieller Zyklus usw. sind wesentlich für die Untersuchung und die Auswertung der Ergebnisse.
Die Gewebeproben werden jeweils in Standardfärbung (HE) und Sonderfärbung (PAS) untersucht. Die Datierung des Endometriums erfolgt in einer Kombination der histomorphologischen mit den immunhistochemischen Untersuchungsergebnissen, mittels Nachweis der Östrogen- und Progesteronrezeptoren sowie der Ermittlung des Proliferationsindex durch Ki-67-Nachweis.
Auf Wunsch kann die Anzahl der NK-Zellen pro mm2 immunhistochemisch (CD56) ermittelt und beurteilt werden.
Die Abklärung einer möglichen chronischen Endometritis, durch Nachweis von Plasmazellen, ist ebenfalls immunhistochemisch (CD38) möglich.
Die Untersuchungen sind IGeL Leistungen und werden daher den Patientinnen privat in Rechnung gestellt.
Ein Formular zur Abrechnung finden Sie unter dem Button Einsender – Formulare zum Download – Abrechnung endometrialer Analysen / PEMA®.
Publikationsverzeichnis
- J Alfer, A Fattahi, N Bleisinger, S Antoniadis, J Krieg, R Dittrich, MW Beckmann, A Hartmann, RM Popovici, K Tremellen
Individual dynamics of uterine natural killer cells in natural and stimulated cycles monitored using a new endometrial dating method
Am J of Reprod Immunol. 2022 Nov;88(5):e13620. doi:10.1111/aji.13620. Epub 2022 Sept 23. PMID: 36148557; PMCID9787954
- J Alfer, RM Popovici, A Fattahi, J Krieg, R Dittrich, M Beckmann, A Hartmann, N Bleisinger
Endometrial delay is found to be part of a normal individual dynamic transformation process.
Archives of Gynecology and Obstetrics 304(6):1599-1609, 2021
- J Alfer, A Fattahi, N Bleisinger, J Krieg, R Behrens, R Dittrich, MW Beckmann, A Hartmann, I Classen-Linke, RM Popovici
Endometrial Dating Method Detects Individual Maturation Sequences During the Secretory Phase.
IN VIVO 34:1951-1963, 2020 - J Alfer, L Happel, R Dittrich, MW Beckmann, A Hartmann, A Gaumann, VU Buck, I Classen-Linke
Insufficient Angiogenesis: Cause of Abnormally Thin Endometrium in Subfertile Patients?
Geburtshilfe Frauenheilkd 77(7):756-764, 2017 - J Alfer, J Neulen, A Gaumann
Lactotrophs: The new and major source for VEGF secretion and the influence of ECM on rat pituitary function in vitro.
Oncol Rep 33(5):2129-34, 2015 - C Stoll, C Stollenwerk, D Riediger, C Mittermayer, J Alfer
Cytokeratin expression patterns for distinction of odontogenic keratocysts from
dentigerous and radicular cysts.
J Oral Pathol Med 34(9):558-64, 2005 - CA Krusche, P Wülfing, C Kersting, A Vloet, W Böcker, L Kiesel, HM Beier,J Alfer
Histone deacetylase-1 and -3 protein expression in human breast cancer: a tissue microarray analysis.
Breast Cancer Res Treat 90(1):15-23, 2005 - S Biesterfeld, D Rickert, S Eichler, K Furste, D Mrusek, J Alfer
TV-image analysis based quantifications of the proliferative activity and the apoptotic rate in thyroid tumors and thyroiditis.
Anticancer Res 23(5b):4269-75, 2003 - J Alfer, F Müller-Schöttle, I Classen-Linke, U von Rango, K Beier-Hellwig, L Happel, W Rath, HM Beier
The endometrium as a novel target of leptin: differences in fertility and subfertility.
Mol Hum Reprod 6(7):595-601, 2000
- M Murtinger, J Alfer, S Miglar, M Schuff, B Wirleitner, D Spitzer
Die chronische Endometritis in der Infertilitätsabklärung: Nutzen oder Überdiagnose?
Gynäkol. Endokrinol. AT(2022).
https://doi.org/10.1007/s41974-022-00219- w - P Vangrieken, SF Vanterpool, FJ van Schooten, S Al-Nasiry, P Andriessen, E Degreef, J Alfer, BW Kramer, U von Rango
Histological villous maturation in placentas of complicated pregnancies.
Histol Histopathol 35(8):849-862, 2020 - AK Gaumann, F Kiefer, J Alfer, SA Lang, EK Geissler, G Breier
Receptor tyrosine kinase inhibitors: Are they real tumor killers?
Int J Cancer 138(3):540-54, 2016 - G von Minckwitz, B Conrad, T Reimer, T Decker, H Eidtmann, W Eiermann, J Hackmann, V Möbus, F Marmé, J Potenberg, E Stickeler, E Simon, C Thomssen, J Huober, C Denkert, J Alfer, C Jackisch, V Nekljudova, N Burchardi, S Loibl; German Breast Group Investigators
A randomized phase 2 study comparing EC or CMF versus nab-paclitaxel plus capecitabine as adjuvant chemotherapy for nonfrail elderly patients with moderate to high-risk early breast cancer (ICE II-GBG 52).
Cancer 15;121(20):3639-48, 2015
- S Bertz, C Abeé, S Schwarz-Furlan, J Alfer, F Hofstetter, R Stoehr, A Hartmann, AK Gaumann
Increased angiogenesis and FGFR protein expression indicate a favourable prognosis in bladder cancer.
Virchows Arch 465(6):687-95, 2014
- S Schwede, J Alfer, U von Rango
Differences in regulatory T-cell and dendritic cell pattern in decidual tissue of placenta accreta/increta cases.
Placenta 35(6):378-85, 2014
- I Classen-Linke, S Moss, K Gröting, HM Beier, J Alfer, CA Krusche
Mammaglobin 1: not only a breast-specific and tumour-specific marker, but also a hormone-responsive endometrial protein.
Histopathology 61(5):955-65, 2012
- T Mumme, P Reinartz, J Alfer, R Müller-Rath, U Buell, DC Wirtz
Diagnostic values of positron emission tomography versus triple-phase bone scan in hip arthroplasty loosening.
Arch Orthop Trauma Surg 125(5):322-9, 2005 - U Miehe, P Neumaier-Wagner, M Kadyrov, P Goyal, J Alfer, W Rath, B Huppertz
Concerted upregulation of CLP36 and smooth muscle actin protein expression in human endometrium during decidualization.
Cells Tissues Organs 179(3):109-14, 2005 - B Hermanns-Sachweh, J Senderek, J Alfer, B Klosterhalfen, R Büttner, L Füzesi, M Weber
Vascular changes in the periosteum of congenital pseudarthrosis of the tibia.
Pathol Res Pract 201(4):305-12, 2005 - U von Rango, CA Krusche, S Kerschanska, J Alfer, P Kaufmann und H.M. Beier
Apoptosis of extravillous trophoblast cells limits the trophoblast invasion in uterine but not in tubal pregnancy during first trimester.
Placenta 24(10):929-40, 2003 - U von Rango, J Alfer, Kertschanska S, B Kemp, G Müller-Neven, PC Heinrich, HM Beier, I Classen-Linke
Interleukin-11 expression: its significance in eutopic and ectopic human implantation.
Mol Hum Reprod 10(11):783-92, 2004 - I Classen-Linke, J Alfer, CA Krusche, K Chwalisz, W Rath, HM Beier
Progestins, progesterone receptor modulators and antagonists change VEGF-release of endometrial cells in culture.
Steroids 65(10-11):763-71, 2000 - M Taguchi, J Alfer, HM Beier, K Chwalisz, I Classen-Linke
Endothelial nitric oxide synthase (ecNOS) is differently expressed in human endometrial vessels during the menstrual cycle.
Mol Hum Reprod 6(2):185-90, 2000 - F Müller-Schöttle, I Classen-Linke, J Alfer, C Krusche, K Beier-Hellwig, K Sterzik, HM Beier
Expression of uteroglobin in the human endometrium.
Mol Hum Reprod 5(12):1155-61, 1999
- CA Krusche, AJ Vloet, I Classen-Linke, U von Rango, HM Beier, J Alfer
Class I histone deacetylase expression in the human cyclic endometrium and endometrial adenocarcinomas.
Hum Reprod 22(11):2956-66, 2007 - B Hermanns, J Alfer, K Fischedick, A Stojanovic-Dedic, S Rudnik-Schoneborn, R Büttner, K Zerres
Pathologie und Genetik hereditärer Zystennieren.
Der Pathologe 24(6):410-20. Review, 2003 - I Classen-Linke, J Alfer, S Hey, CA Krusche, M Kusche, HM Beier
Marker molecules of human endometrial differentiation can be hormonally regulated under in-vitro conditions as in-vivo.
Hum Reprod Update 4(5):539-49. Review, 1998 - K Beier-Hellwig, J Alfer, F Müller-Schöttle, D Crommelinck, C Karl, K Sterzik, HM Beier
Das Endometrium und sein Implantationsfenster.
Reproduktionsmedizin 17:30-41, 2001 - J Alfer, HM Beier
Auch das Endometrium ist ein endokrines Erfolgsorgan für Leptin.
Horme 13. Jahrgang Oktober 2000
- J Alfer, I Classen-Linke, W Rath and HM Beier
Funktional leptin receptor located in human endometrium.
Publiziert in: Hum Reprod 14 Abstr Book 1:266-267, 1999 - J Alfer, L. Happel, K. Beier-Hellwig and H.M. Beier
Significance of marker molecules in the assessment of endometrial quality in infertility patients
Publiziert in: Hum Reprod 14 Abstr Book 1:371-372, 1999 - J Alfer, K Grunwald, I Faridi, J Neulen
VEGF and prolactin colocalization in rat pituitary primary cell cultures
Publiziert in: Hum Reprod 15 Abstr Book , 2000 - J Alfer, K Grunwald, I Faridi, J Neulen
VEGF and prolactin colocalization in rat pituitary primary cell cultures;
Influence of ECM on VEGF secretion.
Publiziert in: Exp Clin Endocrinol Diabetes, 109 (Suppl. 1): 52, 2001 - J Alfer, I Classen-Linke, L Happel, K Beier-Hellwig, HM Beier, Ch Mittermayer,
L Happel, M Thaele
Lack of marker molecules in thin endometrium: evidence for defect angiogenesis in subfertile patients.
Publiziert in: Biomed Pharmacother 56 (No7) 352-353, 2002 - J Alfer, I Classen-Linke, L Happel, K Beier-Hellwig, HM Beier, C Mittermayer
Lack of marker molecules for angiogenesis in abnormal thin endometrium of ovulating subfertile patients.
Publiziert in: Pathology-Research and Practice 198:163, 2002 - J Alfer, I Classen-Linke, L Happel, K Beier-Hellwig, HM Beier, C Mittermayer
Angiogenese assoziierte Moleküle fehlen im Endometrium subfertiler
Patientinnen.
Publiziert in: Der Pathologe, 24:161-162, 2003 - J Alfer, I Faridi, HM Beier, J Neulen
Laktotrophe Zellen als neue und wesentliche Quelle der VEGF Expression in der Hypophyse.
Publiziert in: Der Pathologe 2004 - J Alfer, I.Faridi, HM Beier, J Neulen
Lactotrophs as a new source for VEGF in primary pituitary cell culture are influenced by ECM.
Publiziert in: Pathology-Research and Practice, 200:326, 2004

